Перекись водорода: история открытия, свойства и сфера применения
> Статьи > Короткой строкой > Перекись водорода: история открытия, свойства и сфера применения
 Анонс: Простейший представитель пероксидов, представляет собой вязкую прозрачную жидкость без запаха и вкуса. Проявляет сильные окислительные и восстановительные свойства, благодаря чему это вещество получило широкое распростронение на бытовом и промышленном уровне.
Анонс: Простейший представитель пероксидов, представляет собой вязкую прозрачную жидкость без запаха и вкуса. Проявляет сильные окислительные и восстановительные свойства, благодаря чему это вещество получило широкое распростронение на бытовом и промышленном уровне.
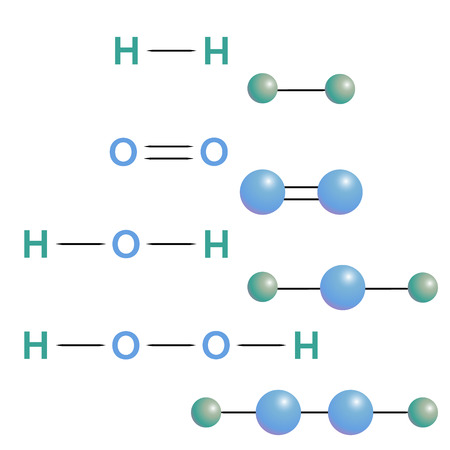
Перекись водорода (систематическое наименование — пероксид водорода, H202) — это самое первое из открытых соединений подобного вида. Вещество представляет собой несимметричную молекулярную связь между водородом и кислородом с образованием сильных полярных связей. Ими обуславливаются основные физико-химические свойства перекиси водорода, ее реакционная способность и активность в качестве растворителя. Перекись водорода считается одним из сильнейших окислителей, в связи с чем это вещество получило широкое распространение как в бытовых, так и в промышленных целях.
История открытия
В чистом виде перекись водорода была выделена в начале 19-го века французскими учеными. Тогда было установлено, что полученное соединение имеет удивительные свойства и занимает промежуточное место между сильными кислотами и их основаниями. Вещество получило неофициальное название «окисленная кислота», после чего его изучение несколько замедлилось. Ученые столкнулись с тем фактом, что исследуемое соединение обладало сильной реакционной способностью, что затрудняло его очищение. Перекись водорода в те времена получали медленным разложением гидроксида бария, который сам по себе является крайне нестабильным веществом.
В начале 20-го века химическая промышленность получила в свое распоряжение новейшие методы электролитического и электрохимического синтеза. Стало возможным получать чистый пероксид водорода путем электрохимической реакции в дистиллированной воде. К середине 20-го века ученым удалось достаточно точно установить химическую формулу пероксида водорода, провести типовые реакции и определить возможности его использования в промышленных или медицинских целях. Сегодня для синтеза перекиси водорода в промышленных масштабах используют каталитическое окисление различных гидрохинонов — этот процесс намного дешевле обычного электролиза.
Физические свойства
Физические свойства пероксида различаются в зависимости от его исходной концентрации. В чистом виде перекись водорода представляет собой прозрачную сиропообразную жидкость с легким характерным запахом. От воды перекись отличается высокой вязкостью, которая объясняется возникновением сильных водородных связей между единичными молекулами. Вещество обладает способностью неограниченно растворяться в полярных растворителях, воде, различных спиртах и эфирах. При этом образуются устойчивые однородные растворы с различными свойствами. Растворы перекиси высокой концентрации взрывоопасны и имеют металлический привкус.
Химические свойства
Для перекиси водорода характерно наличие одновременно окислительных и восстановительных свойств, что объясняется особым состоянием атомов кислорода в молекуле этого вещества. Тем не менее перекись водорода более охотно проявляет окислительные свойства при взаимодействии:
- с металлами;
- гидроксидами;
- солями;
- щелочами.
При этом образуются оксиды или пероксиды других соединений, а перекись водорода восстанавливается до воды. В присутствии других сильных окислителей (кислот или активных соединений) пероксид водорода проявляет свойства восстановителя, что может быть использовано в целях очистки соединений от примесей.
Сфера применения
На бытовом уровне перекись водорода используется в качестве эффективного антисептика для обработки открытых ран и других травм. Установлено, что растворы с концентрацией в 1 % способны полностью убивать большинство патогенных микроорганизмов, не угнетая активность клеток человеческого организма. Кроме того, пероксид водорода обладает способностью мягко очищать ткани от инородных включений. Весьма часто слабые растворы пероксида используются для обесцвечивания волос и пигментных пятен на коже, что может негативно сказаться на состоянии роговых покровов.
Промышленная сфера применения перекиси водорода значительно шире. Благодаря высоким реакционным свойствам это вещество широко используется в качестве катализатора или восстановителя в различных реакциях, в том числе — для очистки металлов. Пероксид водорода является незаменимым компонентом большинства средств бытовой химии, а также используется в пищевой промышленности в качестве безопасного антисептика. Также это вещество нашло применение в сфере энергетики: его используют в качестве окислителя для ракетного топлива, торпед и турбин.
14.08.2016Посмотрите также:
 Первое марта – Всемирный день иммунитета С 2002 года ВОЗ провозгласила 1 марта Всемирным днем иммунитета. Цель такого мероприятия... |
 Почему пыль вредна для здоровья Пыль или аэрозоль – это ни что иное, как измельченные или полученные каким угодно... |
 Причины патологий позвоночного столба Человек – это единственный представитель жизни на Земле, который постоянно передвигается... |
 Медицинские холодильники Большим спросом пользуются различные модели медицинских холодильников, которые превосходно себя... |
 Как предотвратить у лежачего пролежни? Пролежнями страдает большое количество людей, вынужденных находится продолжительное время... |





